

 |
 |
|
Разделы
Публикации
Популярные
Новые
|
Главная » Квазистационарное поведение динамических моделей 1 ... 6 7 8 9 10 11 12 ... 36 Укажем теперь некоторые возможности перевода модели в безразмерную форму. Отнесем все величины (переменные и параметры) к соответствующим характерным значениям. Прежде всего введем характерную температуру [4.10] ш- , где а- . В предельном случае адиабатического режима {11 = 0) а = 0 и Гщ = Го. Безразмерные концентрацию (ы) и температуру {у) определим так: = , У = . (4.1.25) -АО m Введем безразмерные параметры: тепловыделение р, число Дам-кёлера Da, безразмерную э' ергию активации у. о (-Ar)AO k(Tm)C% Е СТ(х+а) =--F- Y = -. (4.1.25а) Уравнения баланса (4.1.23), (4.1.24) после перехода к переменным (4.1.25) принимают вид 1-н-Ван ехр[у (l-у)] = 0, (4.1.26) 1-(/-(-рОаы ехр[у (l -у)] = 0. (4.1.27) Умножая уравнение (4.1.26) на р и складывая результат с уравнением (4.1.27), нетрудно найти соотношение между безразмерной концентрацией и температурой: = (l-f р-(/)/р. (4.1.28) При подстановке этого соотношения в уравнение (4.1.27) мы получаем одно уравнение относительно безразмерной температуры у, описывающее установившийся режим работы реактора: (/-l = p- Daf(r/), (4.1.29) где /(1/) = (1 + Р-у) ехр[у(1-1/(/)]. Безразмерное уравнение (4.1.29) описывает также химические системы, отличающиеся по физическим свойствам от рассматриваемой. Например, уравнения баланса массы и энтальпии, описывающие необратимую реакцию п-го порядка в частице пористого катализатора, в случае отсутствия значительных градиентов концентрации и температуры внутри частицы имеют вид cSx (сАо - са) - Урй (Г) d = О, (4.1.30) Л5х (Го - Г) + (- АЯг) Урй (Г) d = 0. (4.1.31) Здесь fee, /i - коэффициенты массо- и теплоотдачи на внешней поверхности частицы, Sx - площадь внешней поверхности частицы, Ур - объем частицы, а Сдо и Го - концентрация и температура в ядре жидкости, обтекающей частицу (т. е. в невозмущенной жидкости.- Яерев.). Вводя определения из соотношений (4.1.30) и (4.1.31) мы вновь получаем уравнение (4.1.29). Здесь число Дамкёлера Da есть отношение прореагировавшего количества вещества А (при Г = Гдо и с - сдо) к максимально возможному потоку массы этого вещества через поверхность. Таким образом, одна безразмерная система уравнений описывает несколько различных с физической точки зрения задач. 4.1.2.4. Анализ числа стационарных режимов (решений уравнения (4.1.29)) Рассмотрим сначала эндотермические реакции, для которых (-АЯг)<0, р < 0. При этом левая часть уравнения (4.1.29) представляет собой монотонно возрастающую, а правая часть - монотонно убывающую функцию у. Таким образом, в данном случае может существовать не более одного стационарного состояния для любых значений критерия Da. Рассмотрим теперь экзотермическую реакцию (-АЯг > О, Р >0). Перепишем уравнение (4.1.29) в виде Пу)=- = -. (4.1.33) Если предположить, что не(0;1), то из формулы (4.1.28) следует, что г/е (1; 1-f-Р). Если функция F(y) будет монотонно убывать на промежутке (1; 1+Р). то при всех значениях Da будет существовать единственное решение. Для реакции первого порядка это будет иметь место в случае, когда YP<4(l-fP), (4.1.34) для реакции произвольного положительного порядка (п > 0) при условии Т{у) = {п-1)у' + уЦ + у+1 -л)-i/Y(2+ P) + Y(1 + P)>0. (4.1.35) Рассмотрим теперь условия существования нескольких стационарных решений. Если критерий однозначности (4.1.35) выполняется не для всех значений числа Da, то функция F{y) при г/е(1; 1 4-Р) имеет локальный минимум и максимум (см. 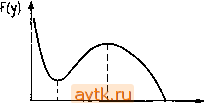 Ушш Углах У Рис. 4.2. Минимум и максимум функции F{y]. рис. 4.2). Таким образом, существуют три стационарных состояния для значений числа Дамкёлера в диапазоне (4.1.36) (4.1.37) Р - Da Например, для реакции первого порядка оказывается y(2+P)±V(yP [уР-4(1-ьР)]) Утах, min - 2 (1 -- Р) Анализу возможности существования нескольких стационарных состояний и примерам их возникновения в задачах теории горения и в моделях реакторов разных типов посвящена обширная литература [4.12-4.21]. 4.2. ЗАДАЧИ С СОСРЕДОТОЧЕННЫМИ ПАРАМЕТРАМИ В этом параграфе мы рассмотрим ряд физических проблем, анализ которых приводит к необходимости исследования систем обыкновенных дифференциальных уравнений. Эти проблемы будут представлены в форме, удобной для иллюстрации численных методов исследования нелинейных систем в гл. 5. Системы дифференциальных уравнений мы будем записывать в виде - = f(x, р), (4.2.1) где хе R , х = (л:1, Хп)-вектор переменных состояния а в вектор р е R* включены параметры системы. При этом решение системы (4.2.1) определяется заданием начальных условий х(0) = х . (4.2.2) 4.2.1. Задача 1. Реактор проточного типа с полным перемешиванием в случае неизотермической реакции и рецикла Рассматриваемый реактор схематически представлен на рис. 4.3. Будем предполагать, что реакционная смесь полностью перемешивается и что объем реактора V, объемный расход Fo, входная концентрация Сдо и температура на входе Го, а также Рис. 4.3. Реактор проточного типа с перемешиванием и рециклом. коэффициент теплопередачи U, площадь поверхности теплообмена S, теплоемкость на единицу объема Ср и теплота реакции (-АЯг) остаются постоянными. Кроме того, мы будем предполагать, что температура охлаждающей среды не изменяется и что в реакторе происходит практически необратимая реакция типа А-> продукты. С учетом этих предположений уравнения баланса массы н энтальпии можно представить в виде dc д l- = F[CAv~ca]-r(ca, Г)У, (Р1-1) YCp = FCp{T.,-T\ + r{c; T){-AHr)V-US{T-T,). (Pl-2) Положим л = Fq/F. Тогда rv = Aro + (l-Л)Г, (Р1-3) Cav = Acao + (1-Л)са. (Р1-4) При этом реактор без рецикла соответствует случаю Л = 1. X =-, температуру число Дамкёлера параметр тепловыделения (-А^г)ао Е энергию активации v = W., температуру хладагента параметр теплоотвода безразмерное время t = tF/V. Тогда уравнения баланса массы и энтальпии переписываются в виде = - Лх -f Da (1 - X) ехр {ттщ) = - Лв -f Da S (1 - X) ехр (jq) - P (© - в,.). (Pl-7) Уравнения (Pl-6), (Pl-7) могут быть представлены в форме (4.2.1), где х = (х, 0), р = (Л, Da, Y, В, р, 0,). Обозначим через т время задержки : т = V/F. Тогда Da = V. Р=ат, где a = US/VCp. (Р1-8) Рассмотрим реакцию 1-го порядка, для которой r = kcA = йсоСд ехр i-E/RT). Определим следующие безразмерные величины: конверсию 4.2.2. Задача 2. Каскад из двух неизотермических проточных реакторов с полным перемешиванием и рециклом Система из двух реакторов схематически представлена на рис. 4.4. Используя те же предположения, что в задаче I, урав- Tq 1 Сдо Ту , Од. Tj.c Рис. 4.4. Два реактора проточного типа с перемешиванием и рециклом. нения баланса массы и энтальпии в этом случае можно записать в виде (Р2-1) {Р2-2) (Р2-3) У г = -Р [са1 - са2] - г (са2, Гг) Fj. = f С, [Г1 - Гг] + г (СА2, Гг) (- АЯг) Уг - г^г (П - Г,г). (Р2-4) Введем следующие безразмерные величины: для /=1, 2 положим , 6, = -(Г,-Го), р,= о (Р2-5а) и, кроме того, примем Е ао У , Dai = &o-, Da2 = &o-/, (P2-5b) CAv = (1 - a) CA2 + Acao. Формулами (Р2-10) время задержки т(= VjF) определено для одинаковых реакторов. - Прим. ред. 7 М. Холодннок н др. Введенные здесь переменные и параметры соответствуют безразмерным величинам, определенным в задаче 1. Аналогичным образом мы поступили бы и в случае каскада, состоящего из большего числа реакторов (для некоторых процессов полимеризации используются каскады, состоящие из 10-12 ступеней). Воспользовавшись формулами (Р2-5), преобразуем уравнения (Р2-1) - (Р2-4) к безразмерному виду (здесь мы вновь рассматриваем реакцию первого порядка) = (1 - Л) Х2 - X, -f Da, (1 - X,) ехр [j) . (Р2-6) = (l-A)02-e, + Da,B(l-,)exp (, J-Р.Св.-в ), (Р2-7) = - -2 + (1 - х^) ехр [j) , (Р2-8) x = 0, - 02 -f Da2B (1 - Х2) ехр ( , Д) - Р2 (вг - 6,2). (Р2-9) Так же, как в задаче 1, можно ввести параметр т, характеризующий время задержки, полагая Da, = Da2 = V, Pi = P2 = at- (Р2-10) Уравнения (Р2-6) - (Р2-9) можно представить в форме (4.2.1), положив х = (х„ 0 Х2, 02), р = (А, Da Da2, Р Рг, 0ci, 02 Y, Р). 4.2.3. Задача 3. Проточный реактор с полным перемешиванием и с автокаталитической системой реакций (модель Нойеса - Филда) Реакция Белоусова - Жаботинского представляет собой процесс окисления малоновой или броммалоновой кислоты ионами броматов в кислой среде, катализированный ионами переходных металлов (церия, железа). При различных условиях в реакторе проточного типа с перемешиванием можно наблюдать длительные автоколебания, несколько стационарных состояний в периодических режимов, хаотическое поведение, а в распределенных системах - распространяющиеся концентрационные волны окисления и восстановления [4.24, 4.25]. Указанная r = 2ksCACX - kCBCz dcz dt (здесь С/ означает концентрацию компоненты /). Введем новые переменные д; = сосх, y = t]CY, z = ycz, t = bt. Тогда кинетические уравнения (РЗ-2) примут вид t-T(*. i-*=+* .v-2*.5-). l-i(2*.-T-*= f) реакция служит моделью при исследовании нелинейных явлений в химической кинетике. Филд, Кёрёш и Нойес [4.26] разработали подробную схему механизма этой реакции, состоящую из одиннадцати основных реакций между двенадцатью компонентами. Позднее Филд и Нойес [4.27] предложили упрощенную схему, состоящую из пяти основных этапов. Обозначим компоненты реакции следующим образом: А==ВгОз, В = ВгМА, Р = НОВг, Х = НВг02, Y = Br, Z = C& и запишем эту реакцию в виде следующей схемы: Константа скорости реакции (l)A-fYX-fP (2) X-f Y->2P k (3) A-f X->2X-f 2Z k (P3-1) (4)2XA-fP &4 (5) B-f Z/iY h Предположим, что компоненты A и В находятся в большом избытке и что их концентрации не зависят от времени. Тогда изменение во времени концентраций остальных компонентов в замкнутой системе можно описать с помощью уравнений -jp- - kCCi - kCyC, -4- зСдСх - 2kc\, 7г = - kiCp,c\ - hcxc\ + hkCBCz, (P3-2) 2kik 2k. k k.k.c = S = 2h, (P3-4) з^а з'а (з'а) Уравнения (РЗ-3) при этом переписываются в следующем безразмерном виде: = liy - xy + x - x. B=-liy-xy + gz, (РЗ-5) §=х-г. Уравнения (РЗ-5) описывают процесс реакции в реакторе с полностью загруженной активной зоной (т. е. без подачи и отвода соответствующих компонент). Таким образом, скорости образования отдельных компонент можно записать как Гх = {\1у - ху + х - х-)/е, г у = (- ,иг/ -ху + gz)/e, (РЗ-6) Гг = Х - г. Тогда уравнения баланса компонент X, Y, Z в реакторе проточного типа с перемешиванием для случая установившегося режима принимают вид {хо, г/о, Zo - соответствующие концентрации на входе) F{Xo-x) + Vr = 0, F{yo-y) + Vr = 0, (РЗ-7) F{Zo-z) + Vr = 0. Компоненты реакции X (НВГО2) и Z (Се+) представляют собой промежуточные продукты, возникающие в ходе реакции. При этом в реактор проточного типа с перемешиванием подается только компонента Y (Вг-). Если хо = 20 = О, то, полагая F/V=, уо = а и вводя затем обозначения х = Х\, у = Х2 и г = хз, уравнения (РЗ-7) Выберем теперь со, г\, у, б так, чтобы полученные уравнения имели максимально простой вид. Положим С учетом формул (РЗ-6) можно переписать в виде [цх - х^х^ + Jf, - Jf?)/e - Рл:, = О, (-р,Х2 - + gxif! + Р (а - 2) = О, л:, - лгз-рл:з = 0. (РЗ-8) Таким образом, для уравнения в форме (4.2.1) в данном случае мы имеем х= {х\, хг, Хз), р= (ц, е, б', р, g, а). Более подробно кинетические модели реакции Белоусова- Жаботинского обсуждаются в работах [4.28, 4.29]. 4.2.4. Задача 4. SH-модель метаболизма тиолов Химические процессы, происходящие при окислении низкомолекулярных тиолов (глютатион, цистеин и т. д.) в клеточных белках, могут быть описаны схемой реакций, представленной на рис. 4.5. Синтез воссгланоЗ/1Енных тио/1ов гротеинов Использодате и деградация -Sh- S Р, -S S p-S  Восстонодлечие протеинов--*SS SH -SH  Окисленные протеины BoccmoHoS/ieHHbie протеины и другие Продукты и другие перекиси субстраты для окисления Рис. 4.5. Упрощенная схема реакций метаболизма тиолов Для изменения во времени концентраций S -Н и S -S групп в низкомолекулярных тиолах при использовании ряда упрощающих предположений можно получить следующую модель [4.30-4.32]: = а (v -f Г)/(1-f Х^) - Z (1-f У), = Х(р + У)-бУ. (Р4-1) (Р4-2) 1 ... 6 7 8 9 10 11 12 ... 36 |
|
© 2004-2025 AVTK.RU. Поддержка сайта: +7 495 7950139 в тональном режиме 271761
Копирование материалов разрешено при условии активной ссылки. |